SynALI 肺模型 – 基于气液界面的肺模型
SynALI 是一种模仿肺结构的新型气液界面模型。微流体装置由由内皮细胞组成的脉管系统包围的上皮细胞功能化。SynALI 结构在气道细胞之间维持一个气液界面。结果,气道小管形成和运输粘液,并由周围的上皮细胞维持。在正常和患病情况下,细胞形态、气道结构、细胞-细胞相互作用和气道功能(例如粘液运输、纤毛跳动、治疗诱导的改善)都可以实时可视化和量化。
联系我们:132 6323 9729(微信同号)
产品详情
SynALI 肺模型 – 基于气液界面的肺模型
SynALI 是一种模仿肺结构的新型气液界面模型。微流体装置由由内皮细胞组成的脉管系统包围的上皮细胞功能化。SynALI 结构在气道细胞之间维持一个气液界面。结果,气道小管形成和运输粘液,并由周围的上皮细胞维持。在正常和患病情况下,细胞形态、气道结构、细胞-细胞相互作用和气道功能(例如粘液运输、纤毛跳动、治疗诱导的改善)都可以实时可视化和量化。
独特的功能包括:
形态逼真的气道结构和环境
横跨上皮和内皮的气液界面 (ALI)
体内血流动力学剪切应力
细胞和屏障功能的实时可视化,包括粘液、纤毛跳动、免疫细胞相互作用和治疗筛查
强大且易于使用的协议
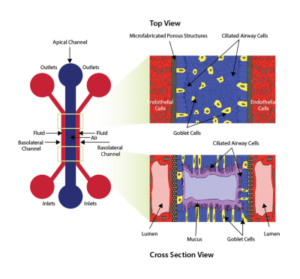
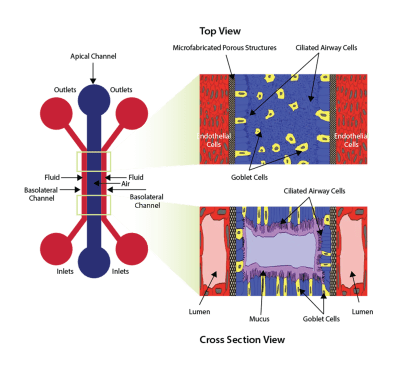
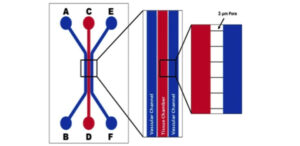
用于开发跨内皮细胞和上皮细胞的气液界面的设备示意图。 空气(或上皮)通道通过微制造的多孔结构与两种流体(基底外侧)通道分开。 右侧面板显示了从顶部和横截面视图中看到的细胞方向。
使用 SynALI 设备开发的模型示例
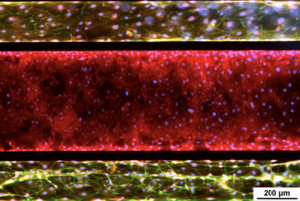
小气道肺模型 – 与人支气管上皮细胞 (HBEC) 和肺微血管内皮细胞共培养。
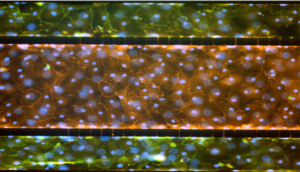
具有人微血管肺内皮细胞和肺泡上皮 I 型和 II 型细胞的肺泡肺模型。
产品购买选项
芯片:根据您的具体研究应用,您可以从 IMN2 线性芯片配置中进行选择。
试剂盒:运行 SynALI 检测所需的所有基本组件都可以作为试剂盒购买。 有两种套件可供选择:
启动套件:首次购买时选择此套件
10 个 SynALI 芯片 -IMN2 线性(3um 狭缝)
配件包括管子、夹子、针头和注射器
气动启动装置(启动管道以去除空气时需要)
检测试剂盒:如果您之前购买了气动灌注装置,请选择此试剂盒格式
10 个 SynALI 芯片 – IMN2 线性(3um 狭缝)
配件包括管子、夹子、针头和注射器
(套件不包括建立气液界面所需的气泵)。
IMN2 线性
理想化共培养网络(IMN2 线性)芯片:3 um 狭缝。 通道宽度; 200-500-200um,50um 行程(通道之间的距离),100um 深度(高度)。 货号:108011
支撑数据
SynVivo 平台用于创建人类气道芯片
阿拉巴马大学伯明翰分校的研究人员报告了使用 SynVivo 平台开发人类气道芯片模型的情况。 结合新型微光学相干断层扫描 (µOCT),该模型可实现纤毛运动的无创定量成像。 成像包括拍频和粘液纤毛运输。
“这种微流体装置的优势在于为气道上皮和相邻的内皮形成完整的管腔。 UAB 医学院儿科肺病学家兼助理教授 Jennifer Guimbellot 博士说,这是在开发一种将细胞分化和组织简化为管状结构的模型方面向前迈出的一步,类似于小气道和微血管系统。
气道模型是通过气液界面 (ALI) 的原代上皮细胞和内皮细胞共培养开发的。 它是使用定制的 SynVivo 微流控芯片创建的,可实现实时定量成像。 通过监测生理条件下的活性纤毛、粘液产生细胞和细胞功能的生物标志物,证明了开发的气道芯片模型的功能。
研究人员的验证
医学教授兼 Gregory Fleming James 囊性纤维化研究中心主任 Steven Rowe 博士表示:“开发能够适当模拟人类完整粘液纤毛运输装置的新工具是一项主要优先事项,并且对气道疾病的生物学研究具有重要意义。 包括囊性纤维化”。 开发的气道模型代表了个性化医疗的新方法,并作为药物开发的预测工具。
针对显微镜和微光学相干断层扫描成像优化的气道共培养微流控模型
作者:Zhongyu Liu、Stephen Mackay、Dylan M. Gordon、Justin D. Anderson、Dustin W. Haithcock、Charles J. Garson、Guillermo J. Tearney、George M. Solomon、Kapil Pant、Balabhaskar Prabhakarpandian、Steven M. Rowe 和 詹妮弗·S·吉姆贝洛特。
生物医学光学快报卷。 10,第 10 期,第 5414-5430 页(2019 年)。
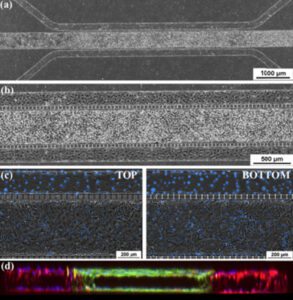
微流控芯片中的上皮和内皮共培养。 (a) 和 (b) 融合共培养芯片的相位对比图像,其中上皮细胞位于中心通道,内皮细胞位于外周通道。 (c) 通道顶部和底部的相位对比显示组织和血管通道中的汇合单层。 这些图像显示了中央通道的顶部和底部以及具有中央清晰内腔的一侧通道上的细胞汇合处。 (d) 共培养芯片的横截面 3-D 重建共焦图像,显示所有三个通道 (10X 放大倍数) 中的管腔形成。 取自 Liu 等人 2019 年。
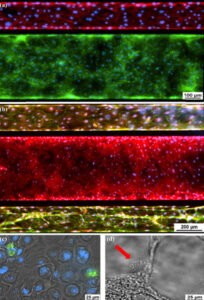
分化的上皮细胞和内皮细胞的免疫荧光。 (a) Ecadherin(绿色),上皮细胞粘附蛋白。 VE-Cadherin(红色),内皮细胞粘附蛋白。 ( b )ZO-1(红色)染色中央通道中上皮细胞的紧密连接以及血管通道中的VE-钙粘蛋白染色(绿色)。 ( c )Muc5ac(绿色),上皮细胞内的细胞内粘蛋白染色。 ( d )由红色箭头指示的纤毛上皮细胞。
小气道肺模型展示粘液形成和生物标志物染色
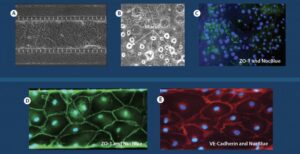
ALI 发展后肺内皮细胞和上皮细胞的 A-C 融合共培养,突出了上皮细胞中粘液的形成和生物标志物的染色。 内皮细胞中紧密连接标记(VE-钙粘蛋白和 ZO-1)的 D-E 生物标记染色。
肺泡肺模型:共培养和三培养选择
与生物标志物染色的共培养
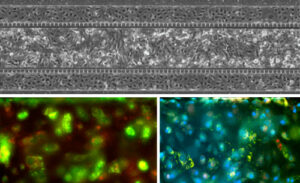
| 生物标志物染色 | 肺内皮细胞、成纤维细胞、上皮细胞的三重培养 |
 |
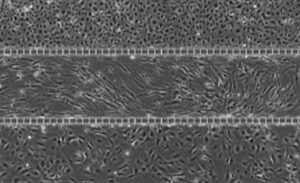 |
| 上图显示了 SynALI 设备中的肺微血管内皮细胞和上皮细胞共培养物。 底部图像:红色:I 型细胞:HT_56 抗体。 绿色:2 型细胞:HT_280 抗体。 蓝色:细胞核。 | SynALI 肺泡模型三培养的相位图像:顶部通道:肺微血管内皮细胞。 中通道:肺成纤维细胞。 底部通道:肺上皮细胞。 |
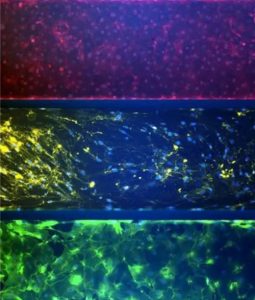
| 生物标志物染色 | 长期三培养和粘液分泌 |
 |
 |
| 三培养肺泡模型显示生物标志物染色——肺内皮细胞中的 VE-钙粘蛋白和 Nuc Blue,中间成纤维细胞层中的肺成纤维细胞表面蛋白和 Nuc Blue 以及上皮细胞中的 E-Cadherin 和 Nuc Blue(底部) | 肺泡肺模型:左图显示第 1 周至第 6 周的培养物。粘液分泌显示在右侧。 |
使用 SynALI 进行检测开发和筛选:
可用型号:
使用原代上皮细胞进行单一培养
与内皮细胞共培养
成纤维细胞的三重培养
化验:
毒性测定
生物标志物分析
治疗筛查
可供选择的端点:
使用荧光标记分子、ROS、生物标志物的血管通透性,收集细胞或流出物用于下游基因组、蛋白质组或转录组分析
文献:
Co-Cultured Microfluidic Model Of The Airway Optimized For Microscopy And Micro-Optical Coherence Tomography Imaging
Authors: Zhongyu Liu, Stephen Mackay, Dylan M. Gordon, Justin D. Anderson, Dustin W. Haithcock, Charles J. Garson, Guillermo J. Tearney, George M. Solomon, Kapil Pant, Balabhaskar Prabhakarpandian, Steven M. Rowe, and Jennifer S. Guimbellot.
Biomedical Optics Express Vol. 10, Issue 10, pp. 5414-5430 (2019).