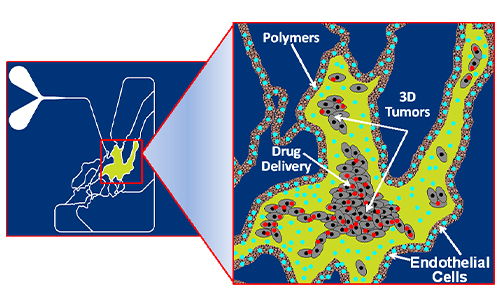
SynTumor 3D 癌症模型——重建肿瘤微环境
SynTumor 是一种 3D 组织模型,用于实时可视化和定量评估生理学和形态学上真实的肿瘤微环境中的细胞-细胞和细胞-药物相互作用。 该系统能够(a)在微脉管系统中循环,(b)跨血管壁运输,以及(c)递送至肿瘤。 从扫描结合间质和组织/肿瘤空间的血管网络开始,SynTumor 3D 组织模型创建了一个类似于可行组织切片的体外肿瘤微环境。
联系我们:132 6323 9729(微信同号)
产品详情
SynTumor 3D 癌症模型——重建肿瘤微环境
SynTumor 是一种 3D 组织模型,用于实时可视化和定量评估生理学和形态学上真实的肿瘤微环境中的细胞-细胞和细胞-药物相互作用。 该系统能够(a)在微脉管系统中循环,(b)跨血管壁运输,以及(c)递送至肿瘤。 从扫描结合间质和组织/肿瘤空间的血管网络开始,SynTumor 3D 组织模型创建了一个类似于可行组织切片的体外肿瘤微环境。
SynTumor 3D 癌症模型具有以下优势:
并排架构实现量化实时可视化
具有工程多孔结构的生理性渗漏脉管系统
形态逼真的基于体内的架构
生理上真实的对流和扩散传输
超低耗材量的微流控平台
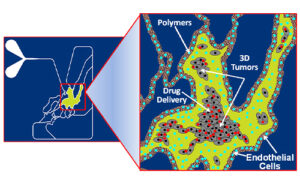
创建逼真的 3D 共培养,实时监测肿瘤、基质、血管和免疫细胞之间的细胞间相互作用。
SynTumor 设备中功能化的模型示例
 |
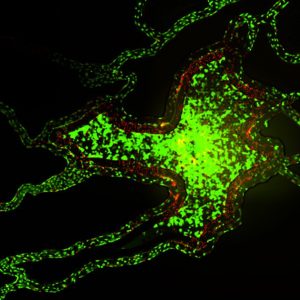 |
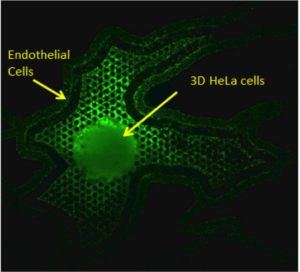
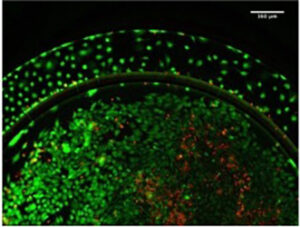
| 在血管通道中培养的内皮细胞。 在微制造支架上培养的 3D HeLa 细胞 | 微血管网络中的肿瘤-内皮相互作用 |
 |
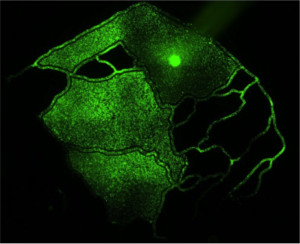 |
| 理想化共培养芯片-血管通道内皮细胞-组织腔内肿瘤细胞 | 用于评估肿瘤转移潜能的多腔模型 |
产品购买选项
芯片:根据您的具体研究应用,您可以在单腔或多腔格式中从理想化的 IMN2(径向或线性)或微血管 (SMN2) 网络芯片配置选择。可以根据是否需要 2D(IMN2、SMN2 芯片)或 3D(IMN3、SMN3 芯片)肿瘤生长来选择芯片。此外,还提供多腔芯片。
试剂盒:运行 SynTumor 检测所需的所有基本组件都可以在试剂盒中购买。有两种套件格式可供选择。
启动套件:首次购买时选择此套件
10 个 SynTumor 芯片(可选择 IMN2 径向、IMN2 线性或 SMN2 微血管网络芯片)
配件包括管子、夹子、针头和注射器
气动启动装置(启动管道以去除空气时需要)
检测试剂盒:如果您之前购买了气动灌注装置,请选择此试剂盒格式
10 个 SynTumor 芯片(可选择 IMN2 径向、IMN2 线性或 SMN2 微血管网络芯片)
配件包括管子、夹子、针头和注射器
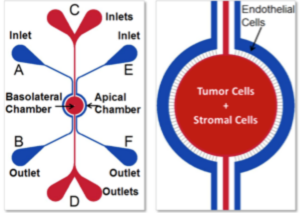
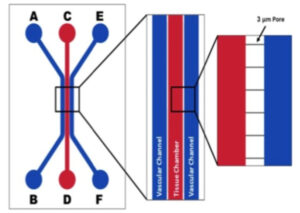
用于开发芯片模型上肿瘤的设备示意图。顶室(外通道-蓝色)用于培养血管(内皮细胞),而基底外侧室(中央室-红色)用于培养组织、基质或免疫成分。多孔结构能够实现血管和组织细胞之间的通信。
理想化的共培养网络芯片(IMN2 径向)
芯片:2um 狭缝(货号:102004)或 8um 柱(货号:102012)。 200μm 外通道,1.8mm 组织室,50μm 狭缝间距,50μm 行程(通道之间的空间),100μm 深度(高度)。 . 8um 立柱设计 – 200um 外通道立柱,8um 间隙,50um 行程—–8/100 um 立柱高度。
启动套件
基于IMN2径向2um狭缝芯片:
基于IMN2径向8um柱芯片:
检测试剂盒
基于IMN2径向2um狭缝芯片:
基于IMN2径向8um柱芯片:
SMN2微血管网络共培养芯片
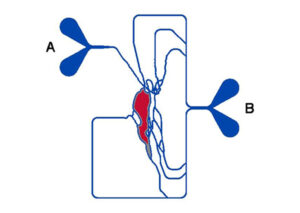
SMN2 共培养微血管网络:2 或 8um 柱。 2 um 高度屏障:20um Dia-3um 分离,100 um 深度。 目录号:105007。8 um 高度屏障:10um Dia-50um 分离,100 um 高度。 货号:105015
启动套件
基于SMN2 2um柱芯片:
基于SMN2 8um柱芯片:
检测试剂盒
基于SMN2 2um柱芯片:
基于SMN2 8um柱式芯片
理想化的共培养网络芯片(IMN2 线性)
理想化共培养网络(IMN2 线性)芯片:3 或 5 um 狭缝 200um-500um-200um 通道宽度; 50um 行程(通道之间的距离)– 3um 或 5um 狭缝 50um 分离,100um 深度(高度) 货号:108011 (3um) 和 108007 (5um)
入门套件
基于IMN2 Linear 3um 狭缝芯片:
基于IMN2 Linear 5um 狭缝芯片:
检测试剂盒
基于IMN2 Linear 3um 狭缝芯片:
基于IMN2 Linear 5um 狭缝芯片:
支持数据
奥本大学 Lipke 和 Arnold 实验室最近在《科学报告》上发表的题为“用于评估抗癌药物疗效的微血管化肿瘤模拟平台”报告了使用 SynVivo 微流体平台开发和验证三维体外乳腺癌模型具有模拟肿瘤的微血管网络。该模型概括了肿瘤灌注的体内异质性以及由此导致的细胞形态、生长和药物反应的差异。
用于评估抗癌药物疗效的微血管化肿瘤模拟平台
作者:Shantanu Pradhan、Ashley M. Smith、Charles J. Garson、Iman Hassani、Wen J. Seeto、Kapil Pant、Robert D. Arnold、Balabhaskar Prabhakarpandian 和 Elizabeth A. Lipke。
科学报告第 8 卷,文章编号:3171(2018)
这项重要的工作源于 Lipke 博士的组织工程背景与 Arnold 博士的癌症生物学和药物递送专业知识的合作。根据 Lipke 博士的说法,“复制天然血管化乳腺肿瘤的病理生理结构和不均匀的药物分布对于真实的肿瘤模型至关重要。 SynVivo 的微血管网络为监测脉管系统中的治疗循环、跨血管壁运输和递送至 3D 肿瘤提供了恰到好处的环境,这使其非常适合作为进行细胞分析和药物筛选的平台”。
Arnold 博士补充说:“这些工程化癌症组织具有长期培养、异质形态和抗癌药物反应的能力,为了解纳米药物如何与各种肿瘤相互作用提供了独特的视角。这将有助于开发具有更高疗效和最小毒性的治疗方法,同时改善患者预后,从而提供一种类似于体内观察到的异质性的体外模型。”
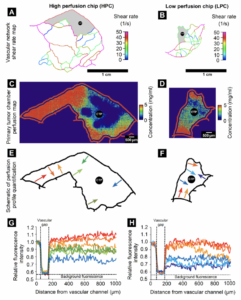
肿瘤模拟芯片内流动模式和灌注曲线的变化。通过计算流体动力学建模获得的 (A) 高灌注芯片 (HPC) 和 (B) 低灌注芯片 (LPC) 的剪切速率图揭示了微流体网络各个通道中局部剪切速率的差异,特别是在原发肿瘤腔室周围。灰色区域)。 (C) HPC 和 (D) LPC 的原发肿瘤腔的灌注热图显示从相邻血管通道灌注到肿瘤腔的荧光 TRITC-葡聚糖浓度的空间差异(CTP 表示中央肿瘤端口)。 (E,F)原发肿瘤室不同区域 HPC 和 LPC 中量化灌注曲线的示意图。箭头表示血管灌注和轮廓测量的方向。红色和橙色箭头代表相对较高的灌注区域,绿色箭头代表中等灌注区域,蓝色和紫色箭头代表低灌注区域。 (G,H)HPC 和 LPC 各个区域的相对荧光强度分布,对应于(E)和(F)中的彩色箭头,揭示了芯片各个区域灌注能力的显着差异。高于 1.0 的强度值表明荧光染料在原发肿瘤腔室内的相对积累或截留。
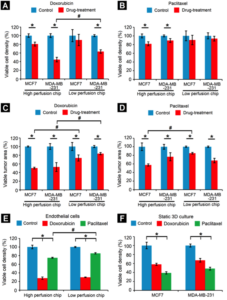
肿瘤模拟芯片中的药物测试。 (A) 多柔比星和 (B) 紫杉醇导致活细胞密度降低。与 LPC 设计相比,HPC 设计中阿霉素处理后的活 MDA-MB-231 细胞密度(与成纤维细胞共同包裹)显着降低;对于 MCF7 细胞(与成纤维细胞共同包裹)没有观察到这种趋势。在紫杉醇处理后,两种芯片设计中的活细胞密度均未观察到显着差异。由于 (C) 多柔比星和 (D) 紫杉醇处理导致的活肿瘤面积(活细胞占据的面积)的减少表明,与 LPC 设计相比,多柔比星导致 HPC 设计中两种细胞系的活肿瘤面积显着减少.紫杉醇治疗导致 MCF7 细胞的存活肿瘤面积显着减少,但 MDA-MB-231 细胞没有。 (E) 在两种芯片设计中,与紫杉醇相比,多柔比星对内皮细胞的细胞毒性表现出更大的细胞毒性。 (F) 降低静态 3D 孔板培养中两种细胞系的活细胞密度。
应用领域
使用 SynVivo-Tumor 模型可以使许多肿瘤学研究领域受益。 这些包括 (1) 了解肿瘤微环境的基础研究,包括细胞活力、增殖、侵袭以及肿瘤-基质和肿瘤-内皮相互作用; (2) 药物递送筛选的有效性和毒性。
了解肿瘤微环境
癌症转移是一个多步骤的过程,从癌细胞离开原始肿瘤部位并通过血流或淋巴系统迁移到身体的远处部位开始。
这个过程涉及复杂的步骤,包括转移性肿瘤细胞破坏细胞外基质、逃逸到循环系统、在远程位置粘附到血管壁上,然后迁移/侵入组织和随后的增殖。
SynVivo 提供了一个真实的微环境,允许对这些现象进行实时研究。
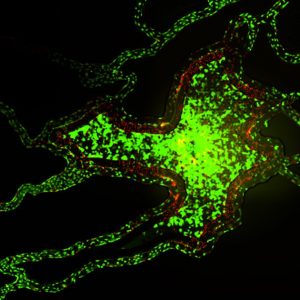 |
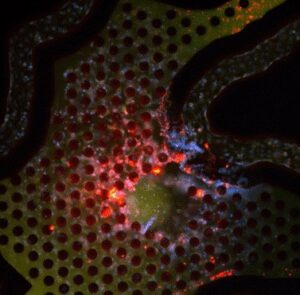 |
肿瘤-内皮共培养模拟了肿瘤微环境,在本例中捕获了侵袭性肿瘤对血管系统通道的细胞外基质降解,这是外渗和转移的前兆。
肿瘤细胞生长和侵袭
2D 肿瘤生长
肿瘤细胞侵袭
3D 肿瘤生长
通过微血管网络芯片中的血管网络进行肿瘤灌注
转移电位表征
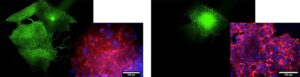
左:高度转移性肿瘤。 右图:非转移性肿瘤。 实时监测肿瘤细胞表型行为。 转移性肿瘤迅速扩散到相邻的腔室(左),而非转移性肿瘤没有(右)。 插图显示了染色图像,突出了转移性肿瘤的细长突起,而不是非转移性肿瘤的局部。 使用该检测方法筛选肿瘤细胞群的转移潜力。
药物递送筛选、功效和毒性
药物或递送载体(纳米颗粒、聚合物、脂质体等)可以通过血管通道或在静态和生理流体流动条件下直接注射到肿瘤上,并且可以模拟体内条件实时观察它们的反应。
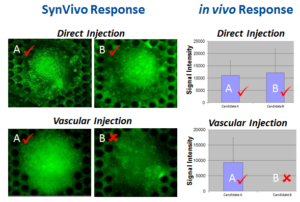
筛选用于基因传递的聚合物准确地再现了体内反应(候选 A 和 B 在直接注射到肿瘤中时表现良好,而在血管注射下候选 A 表现良好而候选 B 表现不佳)。
使用 SynTumor 3D 癌症模型进行分析开发和筛选
可用型号
使用肿瘤细胞系进行单一培养
与内皮细胞共培养
基质细胞和内皮细胞的三重培养
用基质细胞、内皮细胞和免疫细胞培养肿瘤细胞
化验
功效和毒性筛选
肿瘤引起的血管渗漏
肿瘤内渗和外渗
肿瘤免疫相互作用
生物标志物分析
示例端点
使用荧光标记分子的血管通透性、细胞活力、使用免疫细胞化学的生物标志物分析,在测定终点收集和提供细胞或流出物,用于下游基因组、蛋白质组或代谢组分析。
文献:
Articles About This Model:
Rapid Assessment of Nanoparticle Extravasation in a Microfluidic Tumor Model
Author(s): Mai N. Vu, Pradeep Rajasekhar, Daniel P. Poole, Song Yang Khor, Nghia P. Truong, Cameron J. Nowell, John F. Quinn, Michael Whittaker, Nicholas A. Veldhuis, and Thomas P. Davis.
ACS Applied Nano Materials 2 (4), 1844-1856 (2019).
A Microvascularized Tumor-mimetic Platform for Assessing Anti-cancer Drug Efficacy.
Author(s): Shantanu Pradhan, Ashley M. Smith, Charles J. Garson, Iman Hassani, Wen J. Seeto, Kapil Pant, Robert D. Arnold, Balabhaskar Prabhakarpandian & Elizabeth A. Lipke.
Scientific Reports Volume 8, Article number: 3171(2018)
A Biomimetic Microfluidic Tumor Microenvironment Platform Mimicking the EPR Effect for Rapid Screening of Drug Delivery Systems
Author(s): Yuan Tang, Fariborz Soroush, Joel B. Sheffield, Bin Wang, Balabhaskar Prabhakarpandian & Mohammad F. Kiani
Scientific Reports 7, Article number: 9359 (2017)
Microfluidic Co-Culture Devices To Assess Penetration Of Nanoparticles Into Cancer Cell Mass
Author(s): Jarvis M, Arnold M, Ott J, Pant K, Prabhakarpandian B, Mitragotri S.